Erti Ion Dinyahcas Dalam Siri Eletrolisis
Pada anod Ion OH- dan ion. Di katod ion H dipilih untuk dinyahcaskan kerana keududukannya yang lebih rendah daripada ion Na dalam siri elektrokimia.

Download Akueus Mp4 Mp3 3gp Naijagreenmovies Fzmovies Netnaija
Untuk ingat KATION semakin menuruni siri elektrokimia kecenderungan dinyah cas bertambah.
Erti ion dinyahcas dalam siri eletrolisis. Kalau tak dapat nak hafal memang susah lah. Dalam air dan larutkan menjadi 1 liter dalam labu takar. Kedudukan ion dalam siri elektrokimia jenis elektrod kepekatan elektrod logam akan mengkakis.
Encerkan 10 kali untuk membuat 50 ppm stok. Sangat lemah maka ion-ion H dan OH dalam larutan relatif sedikit pada kondisi standar hanya sekitar 10-7 M oleh karenanya elektrolisis air akan berjalan sangat lambat. Materi elektrolisis dipelajari guna untuk mengetahui proses arus listrik saat menguraikan zat elektrolit.
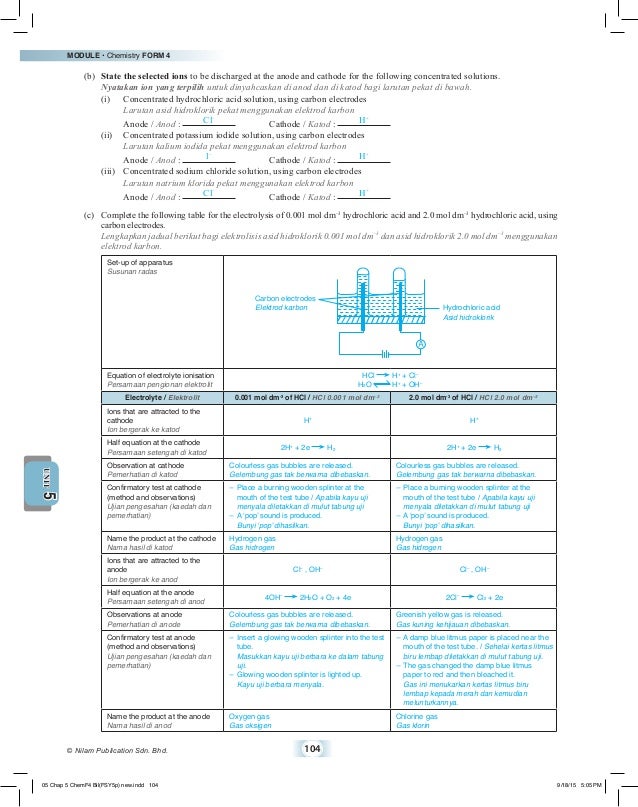
Elektrod manakah adalah a Katod b Anod 3. Jom kita fahamkan sket apa itu Siri Elektrokimia dan cara mudah untuk menghafal Siri Elektrokimia. Animasi berikut menunjukkan prosedur dan pemerhatian eksperimen.
Ion OH terletak di bawah ion Cl dalam Siri Elektrokimia. ELEKTROLISIS LARUTAN AKUES KEDUDUKAN ION DALAM SIRI ELEKTROKIMIA 2. Ada ion bebas dalam larutan elektrolit ada sumber arus DC dari luar punya 2 elektroda katoda dan anoda.
OH ion is selectively discharged by. Ion Cu2 dipilih untuk dinyahcas kerana ia berada di bawah ion H dalam siri elektrokimia. Modifikasi elektrolisis air dapat meliputi penambahan zat.
Contohnya penyepuhan perak yang biasa dilakukan pada peralatan. 2H 2e- H 2 Gas hidrogen terkumpul. Oleh itu ion-ion yang hadir di dalam larutan asid sulfurik ialah H SO 4 2- H and OH-.
Yuk Perdalam Materi Elektrolisis Kelas 12 Ini dan Cari Tahu Manfaatnya buat Kamu. KATION ION POSITIF. Ion OH-dipilih untuk dinyahcas kerana kedudukan yang lebih rendah dalam siri elektrokimia.
Gunakan 50 ppm stok ini untuk membuat larutan yang dibutuhkan. Kegunaan sel elektrolisis antara lain untuk penyepuhan logam produksi aluminium dan produksi natrium. Berikut penjelasan dari masing-masing kegunaan dari sel elektrolisis.
MARI INGAT SIRI ELEKTROKIMIA. Ion yang dipilih untuk dinyahcas faktor pemilihan. Gas oksigen dibebaskan di anod.
Nah biasanya dalam perhitungan pH hukum Faraday I digunakan suatu asambasa kuat. Di anod Elektrod positif Ion hidroksida dipilih untuk dinyahcas kerana ion-ion ini berada pada kedudukan yang lebih rendah dalam siri elektrokimia berbanding ion sulfat. Pada anod ion OH- dipilih untuk dinyahcaskan kerana keududukannya yang lebih rendah daripada ion NO3- dalam siri elektrokimia.
Nyatakan ion yang terdapat di dalam elektrolit. Gas hidrogen adalah dibebaskan di katod. Ion Cl dan ion OH bergerak ke anod.
Nyatakan pemerhatian pada a Katod b Anod 5. Dalam perhitungan pH yang diperlukan adalah konsentrasi ion proton H atau konsentrai ion hidroksida OH-. Larutkan 015 g Na 2 HPO 4 dalam 1 liter air d.
Bunyi Hukum Faraday 1 dan 2 tentang Elektrolisis Kimia Rumus Contoh Soal Pembahasan - Seorang ahli kimia Inggris bernama Michael Faraday pada awal tahun 1830-an menemukan bahwa larutan tertentu dapat segera mengalirkan arus listrik. Bab seperti elektrokimia dan redoks banyak melibatkan Siri Elektrokimia. Larutkan 051 g NaCl dalam.
Siri elektrokimia adalah antara perkara yang paling banyak digunakan dalam pembelajaran subjek Kimia. Cu2 2e- Cu Hasil tindak balas. 4OH- 2H 2 O O 2 4e-Gas oksigen terkumpul.
Ion H dipilih untuk dinyahcas kerana kedudukan yang lebih rendah dalam siri elektrokimia. Ion manakah akan dinyahcas pada a Katod b Anod 4. Semasa elektrolisis hanya satu jenis kation dan anion akan dipilih untuk dinyahcas di elektrod masing-masing.
Ion yang dipilih untuk dinyahcas. Ion yang terletak di kedudukan yang lebih rendah dalam siri elektrokimia akan dinyahcas dengan lebih mudah pada elektrod. By Cikgu NurulJul 25 20213 mins to read.
Arus elektrik dibiarkan mengalir ke dalam asid selama 15 minit. Ciri utama proses elektrolisis. 100 ml air c.
Stok 2000 ppm Na. Jika diketahui satuan coulomb ex 965 C maka bisa didapatkan mol elektron dari persamaan C96500 lihat rumus di atas. Cl ion and OH ion move to the anode.
Posisi ion pada siri elektrokimia Ion yang berada di bawah dalam siri elektrokimia akan dipilih untuk dinyahcas 1. Penyepuhan logam bertujuan melapisi logam dengan logam lain agar tidak mudah berkarat. Elektrolisis Larutan Akues Elektrolisis Larutan Kuprum II Klorida Cair Kesan kedudukan ion dalam siri elektrokimia pada elektrolisis sebatian akues.
Oleh itu ion-ion yang hadir di dalam larutan asid sulfurik ialah H SO 4 2- H and OH Di anod Elektrod positif Ion hidroksida dipilih untuk dinyahcas kerana ion-ion ini berada pada kedudukan yang lebih rendah dalam siri elektrokimia berbanding ion sulfat. 100 ppm Al Larutkan 018 g A1 2 SO 43K 2 SO 4 dalam. Untuk itu perlu dilakukan modifikasi terhadap elektrolisis air.
Oleh itu terdapat dua jenis kation ion kuprumII dan ion hidrogen dan dua jenis anion ion sulfat dan ion hidroksida hadir dalam larutan akueus. OH ion is lower than Cl ion in the Electrochemical Series. Maksudnya antara dua yang di bawah lebih rendah kedudukannya akan dipilih untuk dinyah cas iaitu akan MENERIMA elektron membentuk atom ion kaliuk K kalau.
Ia menamakan larutan tersebut dengan elektrolit dan aliran listrik yang melalui larutan elektrolit disebut elektrolisis. Siri Elektrokimia Siri elektrokimia ialah satu siri penyusunan unsur-unsur mengikut tertib kecenderungan melepaskan elektron untuk membentuk ion positifSemakin tinggi kedudukan satu logam dalam siri elektrokimia semakin senang logam itu membentuk ion positifSiri elektrokimia dibina berdasarkanperbezaan voltan bagi pasangan logam dalam sel kimiakebolehan logam menyesarkan.
Elektrolisis Tingkatan 4 Flip Ebook Pages 1 32 Anyflip Anyflip

I Rdina Kssm Sains Tingkatan 5 Membalik Buku Halaman 201 250 Pubhtml5




Comments
Post a Comment